WuXi Biologics
Offering End-to-End Solutions
案例分析
新药发现服务的范例分析
范例分析:在大肠杆菌中表达可用作结构分析的CYP-X蛋白
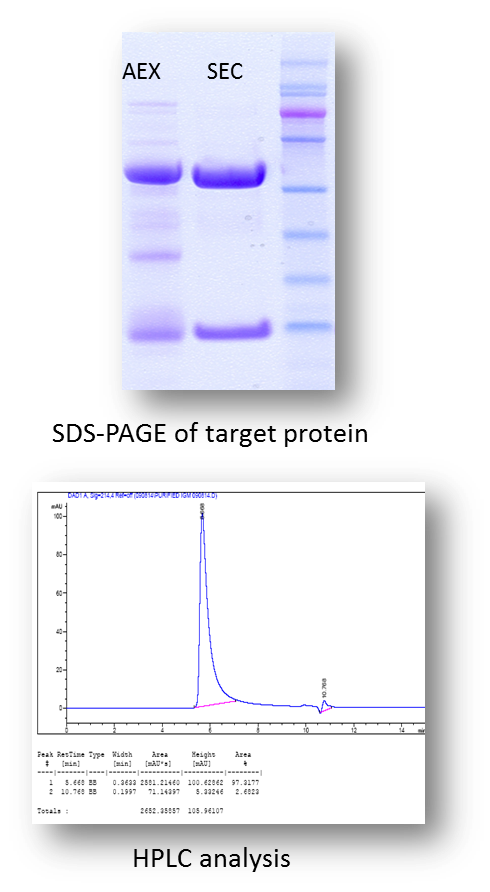
范例分析:纯度可超过95%的IgM生产
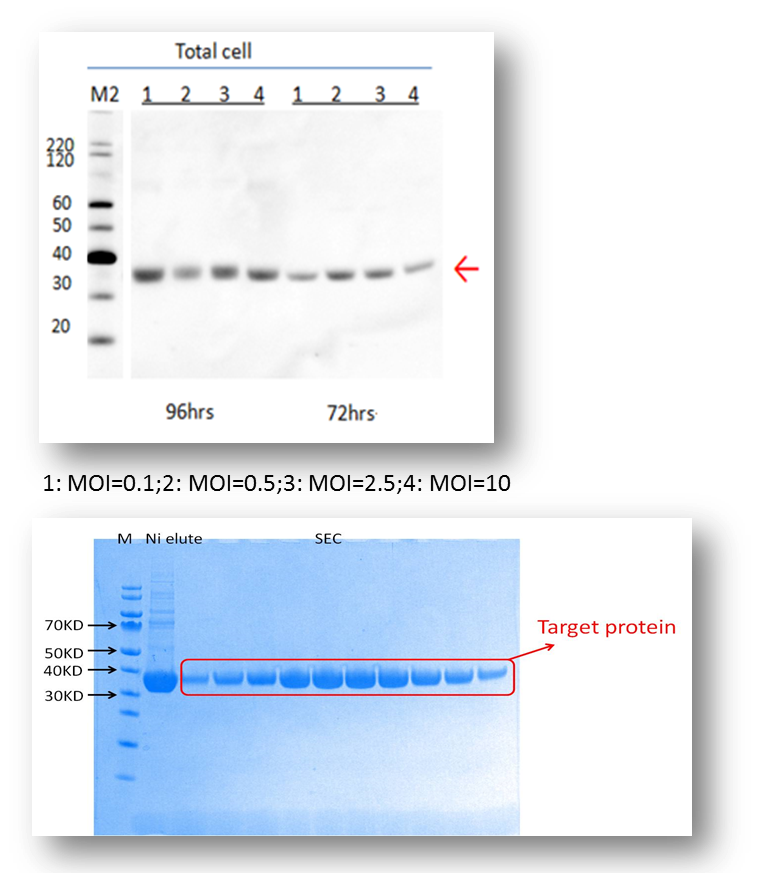
范例分析:用杆状病毒感染的昆虫细胞表达系统来生产激酶-Y
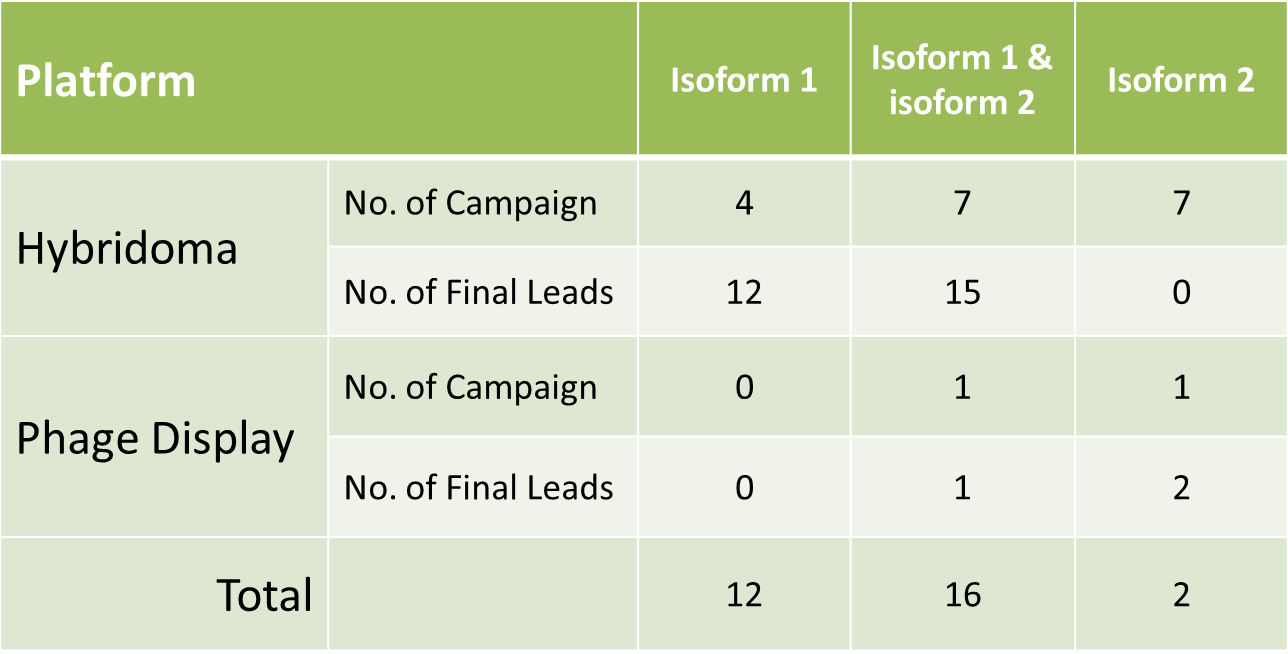
范例分析:采用不同的抗体筛选平台获得种型特异性抗体
范例分析:从药明生物自主构建的全人天然抗体噬菌体库中筛选抗体药物
背景
用药明生物自己建立的全人天然抗体库中获得特异性识别抗原1的两个剪接异变体1a和1b的抗体。
挑战
- 靶标抗原有两个剪接体(1a和1b),之间区别大于20个氨基酸。
- 杂交瘤技术不能得到选择性识别1b抗原的抗体。
解决方案/结果
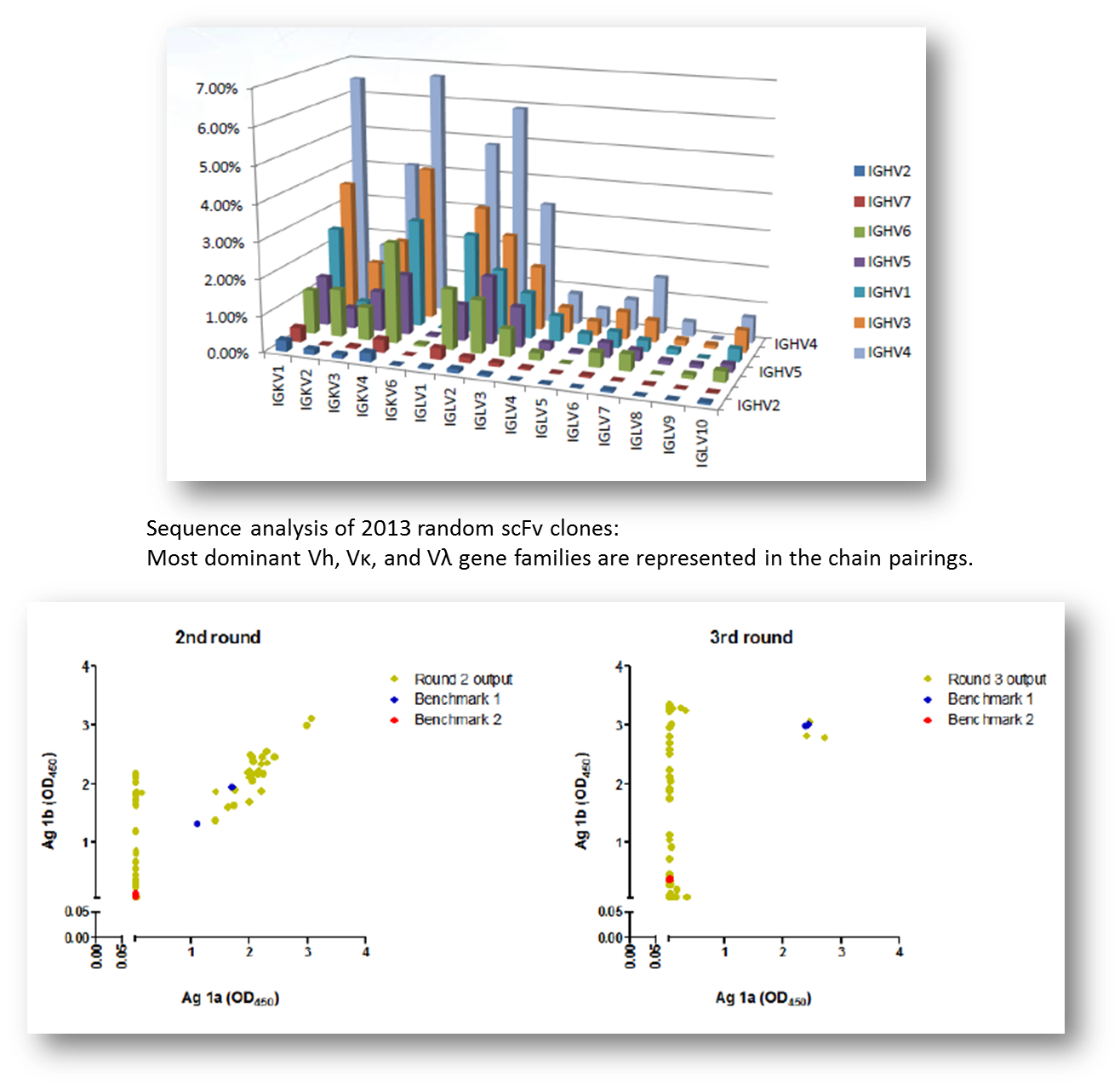
用抗原1b作为筛选目标,同时加入抗原1a作为竞争剂,从人天然抗体噬菌体库中筛选抗体,用单克隆抗体噬菌体ELISA检测第二轮和第三轮的产物, 寻找特异性结合的抗体噬菌体。筛选中我们发现,第三轮的产物中抗原1b特异性的抗体获得富集,而抗原1a和1b的交叉结合抗体相应减少。序列分析第三轮的阳性克隆,得到6个不同序列的抗体株,其中2个和细胞表面表达的抗原1b有非常强的结合 (数据未显示)。
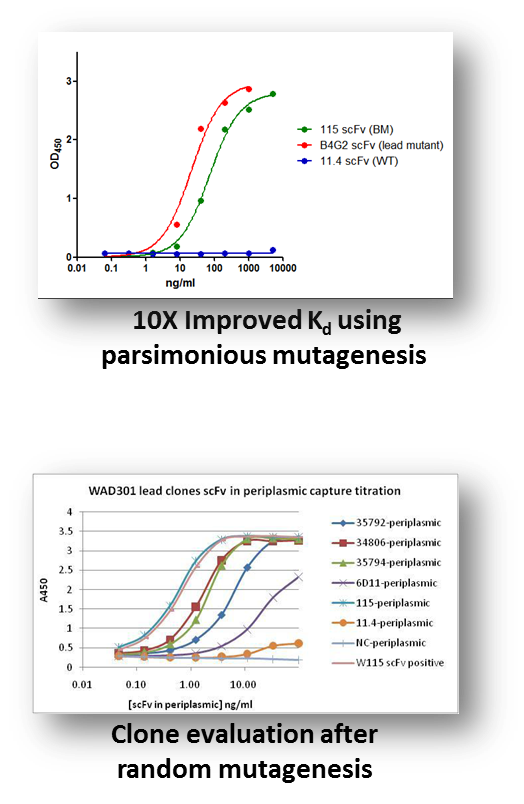
范例分析: 用亲和力成熟获得Kd值在皮摩尔级别的抗体
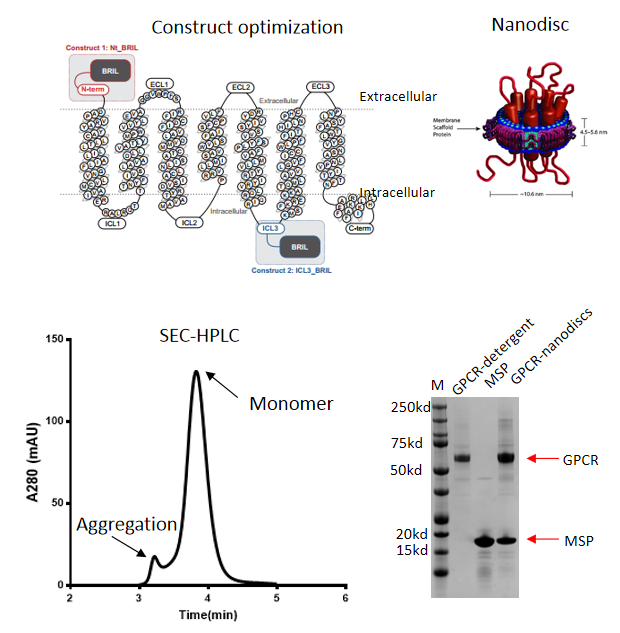
Case Study: GPCR Production
Aim
Production of a high quality GPCR protein in insect cells
Reconstitution of GPCR into nanodiscs
Key Challenges
Expression level of GPCR was very low <0.2 mg/L
The protein was unstable and its conformation was very flexible
It was hard to reconstitute GPCR into nanodiscs
Results
- Expression constructs were optimized
- ~1.5 mg/L was achieved after optimizing expression and purification protocol
- Purity >90%
- GPCR’s conformation was stabilized by suitable ligand
- GPCR-nanodiscs was successfully assembled